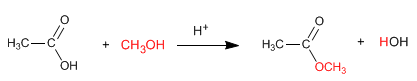miércoles, 9 de noviembre de 2016
martes, 1 de noviembre de 2016
Acidos Nucleicos
Los ácidos nucleicos son grandes moléculas constituidas por la unión de monómeros, llamados nucleótidos. Los ácidos nucleicos son el ADN y el ARN. Los nucleótidos son moléculas que se pueden presentar libres en la Naturaleza o polimerizadas, formando ácidos nucleicos.


Bases nitrogenadas
Las Bases Nitrogenadas son las que contienen la información genética, éstas presenta una estructura cíclica que contiene carbono, nitrógeno, hidrógeno y oxígeno.3 Se dividen en dos tipos:
Purinas, que son derivadas de la purina (dos anillos).
Pirimidinas, derivadas del anillo de la pirimidina (un anillo).
La presencia de los átomos de nitrógeno le da un carácter básico a estos compuestos. Son aromáticas y por lo tanto son planas, también son insolubles en agua y pueden establecer interacciones hidrofóbicas entre ellas; estas interacciones sirven para estabilizar la estructura tridimensional de los ácidos nucleicos.4 La existencia de distintos radicales hace que puedan aparecer varias bases nitrogenadas, las cuales son:
-Adenina, presente en ADN y ARN
-Guanina, presente en ADN y ARN
-Citosina, presente en ADN y ARN
-Timina, presente exclusivamente en el ADN
-Uracilo, presente exclusivamente en el ARN
Secuencia de los cuatro posible unidades de la cadena de un ácido ribonucleico.
REFERENCIA BIBLIOGRAFICA:
TOMADO DE: Química organica, Editoria Alhambra.
https://es.wikipedia.org/wiki/%C3%81cido_nucleico
sábado, 15 de octubre de 2016
Obtención de Hidrógeno a través de una disolución de Zinc
Introducción:
Para la obtención de Hidrógeno a través de una disolución de Zinc en el laboratorio de química utilizamos los siguientes materiales:
El hidrógeno es la sustancia mas inflamable de
todas las que se conocen. Es un poco mas soluble en disolventes
orgánicos que en el agua.
Para la obtención de Hidrógeno a través de una disolución de Zinc en el laboratorio de química utilizamos los siguientes materiales:
- Base universal
- Varilla universal
- Soporte universal
- Nuez de laboratorio
- Matraz de Erlenmeyer
- Triangulo de asbesto
- Mechero Bunsen
- Manguera
- Tubo de ensayo
- Vaso precipitado 600 ml.
Representación del montaje:
Procedimiento:
Para obtener el hidrógeno se prepara una solución diluida de ácido clorhídrico se le adiciona granallas de Zinc, se observa que se produce una reacción rápida, y se observa el desprendimiento un gas que atraviesa la manguera y llega al tubo de ensayo, para confirmar si lo que hay en el tubo es hidrógeno se acerca al mechero el cual debe hacer una explosión
La reacción es la siguiente: Zn + 2HCl -> ZnCl2 + H2
'S'
Conclusión: la conclusion queda en espera para ver cuales son los resultados de la practica, muchas gracias.
martes, 6 de septiembre de 2016
Amidas
Compuestos orgánicos que pueden considerarse derivados de ácidos o aminas, se derivan de los ácidos carboxílicos alifáticos o aromáticos, así como de otros tipos de ácidos, como los que contienen azufre o fósforo. Las amidas son, generalmente, de naturaleza neutra con
respecto a su capacidad de reacción en comparación con los ácidos o aminas de los que se derivan y algunas de ellas son ligeramente resistentes a la hidrólisis.
Las amidas son comunes en la naturaleza y se encuentran en sustancias como los aminoácidos, las proteínas, el ADN y el ARN, hormonas y vitaminas.
Nomenclatura.
Las amidas se nombran como derivados de ácidos carboxílicos sustituyendo la terminación -oico del ácido por -amida.
Las amidas son grupos prioritarios frente a aminas, alcoholes, cetonas, aldehídos y nitrilos.
Las amidas actúan como sustituyentes cuando en la molécula hay grupos prioritarios, en este caso, preceden el nombre de la cadena principal y se nombran como carbamoíl
Cuando el grupo amida va unido a un ciclo, se nombra el ciclo como cadena principal y se emplea la terminación -carboxamida para nombrar la amida.
Métodos de obtención
Uno de los principales métodos de obtención de estos compuestos consiste en hacer reaccionar el amoniaco (o aminas primarias o secundarias) con ésteres.
1. Las amidas se pueden convertir directamente en ésteres por reacción de los alcoholes en medio ácido
2.Las amidas primarias poseen reacciones especiales:
3.Se pueden deshidratar por calefacción con pentóxido de fósforo (P2O2) formando nitrilos
4.Reaccionan con el ácido nitroso, formando el ácido carboxílico y nitrógeno
5.Las amidas se pueden hidrolizar (romper por acción del agua)
En conclusión, las amidas por hidrólisis ácida dan ácidos ; por hidrólisis básica dan sales; con alcoholes producen ésteres; y por deshidratación producen nitrilos.
Propiedades Físicas
La metanamida es liquida, todas las demás amidas simples son sólidas a temperatura ambiente.
Por ser un grupo polar, es bastante soluble en Agua.
La mayoria de amidas son incoloras e inodoras
Los puntos de fusión y ebullición de las amidas secundarias son bastante menores.
Las amidas terciarias no pueden asociarse, por lo que son líquidos normales, con puntos de fusión y ebullición de acuerdo con su peso molecular.
Propiedades Químicas
Basicidad
Las amidas son solo muy débilmente básicas, debido a la interacción mesómera entre el
doble enlace carbonílico y el par de electrones del átomo de nitrógeno.
Hidrólisis ácida de las amidas
La hidrólisis ácida de las amidas primarias produce ácido orgánico libre y una sal de amonio. Las amidas secundarias y terciarias producen el correspondiente ácido y una sal de amonio cuaternario.
Hidrólisis básica de las amidas
La hidrólisis básica de las amidas produce una sal de ácido orgánico y amoniaco o aminas, según el tipo de amida.
Reacción de las amidas con el Ácido Nitroso
El ácido nitroso suele emplearse para convertir grupos amino en grupos hidroxilo. Así, cuando las amidas primarias se tratan con ácido nitroso se forma el ácido orgánico correspondiente y se desprende nitrógeno gaseoso, de acuerdo a la siguiente reacción.
Reacción de Hoffman (Formación de aminas)
Esta reacción proporciona un método para preparar aminas puras con un átomo de carbono menos que la amida inicial. Una solución acuosa de la amida se trata con hipoclorito o hipodromito de sodio e hidróxido de sodio. Esta reacción es característica de las amidas primarias.
Reducción de amidas (Formación de aminas)
El hidruro de litio y aluminio convierte a las amidas en aminas. En este caso, la amina tiene igual número de carbonos que la amida.
Las amidas no sustituidas de los ácidos carboxílicos alifáticos se utilizan ampliamente como productos intermedios, estabilizantes, agentes de desmolde para plásticos, películas, surfactantes y fundentes. Las amidas sustituidas, como la dimetilformamida y la dimetilacetamida tienen propiedades disolventes muy poderosas. La dimetilformamida se utiliza principalmente como disolvente en procesos de síntesis orgánica y en la preparación de fibras sintéticas. También constituye un medio selectivo para la extracción de compuestos aromáticos a partir del petróleo crudo y un disol- vente para colorantes. Tanto la dimetilformamida como la dimetilacetamida son componentes de disolventes de pinturas. La dimetilacetamida se emplea también como disolvente de plásticos, resinas y gomas y en numerosas reacciones orgánicas.
Ésteres

Los ésteres más comúnmente encontrados en la naturaleza son las grasas, que son ésteres de glicerina y ácidos grasos (ácido oleico, ácido esteárico, etc.) Principalmente resultante de la condensación de un ácido carboxílico y un alcohol. El proceso se denomina esterificación.
Tipos de ésteres.
En los ésteres más comunes el ácido en cuestión es un ácido carboxílico. Por ejemplo, si el ácido es el ácido etanoico o acético, el éster es denominado como etanoato o acetato. Los ésteres también se pueden formar con ácidos inorgánicos, como el ácido carbónico (origina ésteres carbónicos), el ácido fosfórico (ésteres fosfóricos) o el ácido sulfúrico. Por ejemplo, el sulfato de dimetilo es un éster, a veces llamado "éster dimetílico del ácido sulfúrico".
Impactos que suponen la fabricación o uso de estas sustancias, tanto para el medio ambiente como para la salud humana.
En general el uso de esteres, tanto para el medio ambiente como para la salud humana, tiene un efecto negativo.
Los ésteres de ftalatos, principalmente conocidos como plastificantes, son un grupo de productos químicos industriales utilizados para la fabricación de plásticos más flexibles, como el PVC. Hoy en día, se considera que por su elevada toxicidad, volatilidad y persistencia en el medio, la exposición ambiental a los ésteres ftalatos es uno de los más probables responsables de ocasionar enfermedades como cáncer, malformaciones congénitas, pérdida de calidad en el semen masculino y esterilidad, además de ser uno de los principales contaminantes de la atmosfera por su participación en reacciones fotoquímicas.
Lo anterior, se ha dado debido a que hoy en día la utilización de este tipo de ésteres se ha expandido a la fabricación de juguetes, envases de alimentos, lubricantes, detergentes, pesticidas, cosméticos, y en general productos con los que tenemos contacto diario, lo que ocasiona que al tocar nuestra piel sea fácilmente absorbido. Sin embargo, los ésteres de ftalatos son utilizados por su bajo costo, aunque en países como los de la Unión Europea, estas sustancias químicas han sido prohibidas por sus efectos nocivos.
Obtención
Los esteres se obtienen por medio de la reacción de esterificación, donde estos compuestos surgen como productos cuando a condiciones ideales reacciona un alcohol con ácido carboxílico en presencia de ácidos minerales. Asimismo, la reacción se realiza en exceso de alcohol para desplazar los equilibrios a la derecha.
La reacción de esterificación es la siguiente: ácido + alcohol -->éster + agua
Propiedades físicas:
Los que son de bajo peso molecular son líquidos volátiles de olor agradable. Son las responsables de los olores de ciertas frutas.Los ésteres superiores son sólidos cristalinos, inodoros. Solubles en solventes orgánicos e insolubles en agua. Son menos densos que el agua.
Propiedades Químicas:
Hidrólisis ácida: Ante el calor, se descomponen regenerando el alcohol y el ácido correspondiente. Se usa un exceso de agua para inclinar esta vez la reacción hacia la derecha. Como se menciono es la inversa de la esterificación.
Hidrólisis en medio alcalino: En este caso se usan hidróxidos fuertes para atacar al éster, y de esta manera regenerar el alcohol. Y se forma la sal del ácido orgánico.
Suscribirse a:
Entradas (Atom)